检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
植物地上部分来源于茎尖分生组织 (Shoot Apical Meristem, SAM)。KNOX1家族转录因子 SHOOT MERISTEMLESS (STM) 维持SAM稳态。尽管与 STM 序列相近的 KNOTTED-LIKE FROM ARABIDOPSIS THALIANA 6 (KNAT6) 等三个KNOX1 转录因子表达区域与 STM 高度重合,但对 SAM 维持作用微弱。
2023年9月6日,Molecular Plant 在线发表了金沙威尼斯欢乐娱人城焦雨铃课题组和中国科学院大学金沙威尼斯欢乐娱人城汪颖课题组合作研究论文,题为Condensation of STM is critical for shoot meristem maintenance and salt tolerance in Arabidopsis。团队之前的研究发现STM自激活促进分生组织维持。在此基础上,新的研究发现STM不保守的N端具有一段朊病毒样结构域 (Prion-like Domain, PrD),驱动STM在细胞核内形成蛋白凝集。蛋白凝集能够增强 STM 的转录活性,且盐处理后凝集增强。与 STM 高度同源的 KNAT6 蛋白不具有蛋白凝集能力。这些发现揭示了STM蛋白功能的特殊性。
研究团队发现STM在细胞核中形成点状凝集,信号分布不均匀 (图1A, 1B),结构分析表明STM结构高度无序的N端具有一个明显的PrD (图1C),可以诱导蛋白凝集产生。体外凝集实验也表明N端可以驱动STM形成蛋白凝集 (图1D, 1E)。体内蛋白凝集分析发现NaCl可以特异性增强STM蛋白凝集,而抑制蛋白凝集的1,6-己二醇 (1,6-hexanediol显著抑制STM凝集产生 (图1F, 1H)。

图1 含PrD结构的N端驱动STM形成蛋白凝集
蛋白凝集形成经常涉及多种大分子互作,本研究发现与 STM蛋白互作的BELL 家族成员在体外和体内形成蛋白凝集,且与STM凝集共定位。此外,该研究还发现中介体 (Mediator) 组分 MED8与STM蛋白互作,MED8 蛋白也具有明显的PrD结构域并与 STM蛋白形成共定位的凝集。以上发现说明BELL家族成员和中介体均与STM蛋白形成凝集。分子生物学和转录组分析表明STM蛋白凝集形成增强转录活性,对下游靶基因的转录激活作用显著增强。研究进一步发现 SAM 的维持依赖于 STM 蛋白凝集的形成。盐处理能够增强 STM 蛋白凝集,盐处理实验也增强了分生组织活性,导致更多侧芽形成 (图2)。
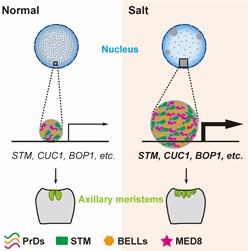
图2 STM蛋白凝集模型
本研究发现STM在细胞核中形成蛋白凝集,找到了与STM蛋白互作且共同形成凝集的两类蛋白—BELL和MED8,发现凝集形成能够增强STM自身转录调控活性,是 STM 具有分生组织活性,维持 SAM 的基础。此外,还发现盐处理增强 STM 蛋白凝集,使分生组织在高盐下具有更强的活性。本研究不仅丰富了对STM蛋白作用机制的认识,也将植物分生组织活性和耐盐性直接联系在一起,为后续耐盐植物的培育提供理论基础。
中国科学院遗传与发育生物学研究所已出站博士后曹秀卫为论文的第一作者,已毕业研究生杜青伟和郭亚鹤参与了此工作,金沙威尼斯欢乐娱人城生科院焦雨铃教授和中国科学院大学生科院汪颖副教授为论文的共同通讯作者,该研究得到了国家自然科学基金和中国博士后面上项目资助。
原文链接:https://www.cell.com/molecular-plant/fulltext/S1674-2052(23)00257-5