检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
1988年,加州大学洛杉矶分校Michael Grunstein教授团队发现,真核细胞中的核小体不仅仅是供DNA缠绕的结构,它在调节基因表达上还有着重要作用【1】。此后,随着表观遗传学先驱David Allis教授在1996年对组蛋白尾部修饰酶的突破性发现【2】和2001年提出的Histone Code假说【3】,人们对染色质结构与基因转录调控之间关系的理解进入了崭新的一页。在一系列组蛋白新修饰被鉴定【4】的同时,人们迫切地想知道这些特异性修饰的性质和功能有何异同,又是如何调控基因表达?例如,越来越多的证据表明,来自环境的代谢物会通过染色质的修饰实现基因转录调控【5】,但作为表观遗传调控的重要分子基础,很多修饰对基因表达调控的影响尚不清楚,亟需对这些多层次的表观遗传信息加以解析和关联。
2023年3月2日,金沙威尼斯欢乐娱人城季雄组与化学与分子工程学院陈鹏组合作在Cell杂志发表了题为“Linking chromatin acylation mark-defined proteome and genome in living cells”的研究论文,发展了在活细胞内“关联解析”蛋白质修饰机制与功能的“单位点-多组学”技术-SiTomics,揭示了受染色质酰化修饰介导的丰富的互作组学信息,建立了表观遗传调控的蛋白质组与基因组“信息关联”。

传统的生物学方法往往借助抗体识别原位研究蛋白质的翻译后修饰,对抗体的特异性具有很高要求,为克服这些局限性,本研究发展了一种具有单氨基酸位点分辨率的多组学技术Single-site-resolved multi-omics(SiTomics,图1)。通过将一系列带有赖氨酸酰化修饰的“光交联”非天然氨基酸,以位点特异的方式引入活细胞内的组蛋白当中,原位模拟内源修饰在基因组上的分布,并与蛋白质光交联和组学鉴定技术、基因组测序技术等相结合,系统性地开展了由位点特异的修饰介导的染色质相互作用蛋白质组与基因组“关联鉴定”。
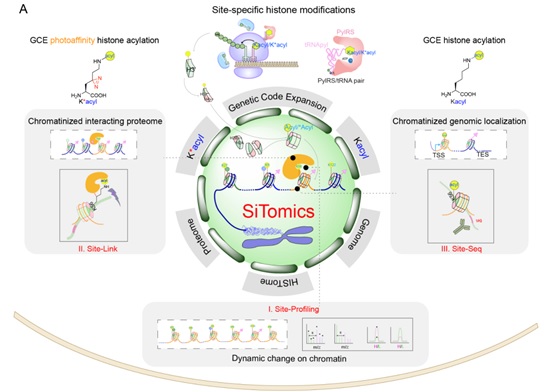
图1“关联解析”染色质动态修饰机制与功能的“单位点-多组学”技术-SiTomics (Single-site-resolved multi-omics)。
I. Site-Profiling: 单位点修饰的动态变化情况的比较, II. Site-Link: 通过遗传密码子拓展技术在组蛋白上引入K*acyl,利用光交联蛋白质组学鉴定单位点修饰的相互作用蛋白质组, III. Site-Seq:通过遗传密码子拓展技术在组蛋白上引入Kacyl,结合传统ChIP-seq技术研究具有修饰的核小体在基因组中所处的位置。
“单位点分辨”的动态修饰定量鉴定
组蛋白修饰位点众多,不同位点对代谢物响应程度的定量比较,会因不同多肽对质谱响应的差异而难以实现。如组蛋白H3K56处在DNA缠绕进出口的位置,在复制、转录和修复等过程中具有重要意义,由于该位点抗体效果差,研究进展缓慢。在之前的研究中,人们往往利用同位素标记的代谢物处理细胞并鉴定同位素标记的修饰肽段,但这样的方法会损失一些动态变化信息,尤其是对修饰量减少或者原有修饰经擦除后重新被修饰的情况,都难以提供丰度信息。利用SILAC技术标记赖氨酸和精氨酸,整合平行比较同样长度、修饰和电荷数的同一肽段的变化情况,可以更为精准地定量比较修饰的动态变化(Site-Profiling, I)。最终,通过加权分析鉴定出H3K56位点在短链脂肪酸(如巴豆酸、b-羟基丁酸)处理下,都显著地发生了相应的酰化修饰。
互作蛋白质组与染色质分布的“协同解析”
将Site-Link技术应用于H3蛋白的K37, K56和K79等位点(H3K*56ac,H3K*56cr,H3K*56bhb,H3K*56PABK*,H3K*37cr,H3K*79cr),利用对这些带有光交联探针的组蛋白进行交联-富集和质谱鉴定,获得了不同位点/修饰的相互作用蛋白质组信息,发现不同“位点-修饰”组合的确具有独特的相互作用蛋白质组。
接下来,作者对巴豆酰化修饰进行了细致的研究(图2)。与H3K4me3一样,赖氨酸的巴豆酰化修饰(Kcr)被报道分布于基因组启动子区域。将SiTomics技术应用于H3K56cr,确实捕获到一系列报道与H3K4me3相互作用的蛋白质,随机选取H3K4me3在基因组中分布的位点验证H3K56cr也分布在这些位置。另外,研究发现H3K56cr具有一个非常特异的相互作用蛋白GLYR1,与H3K56位的其他修饰基本都没有结合。鉴于之前的报道显示GLYR1主要分布在基因内部(gene body)区域,作者推断GLYR1可能与巴豆酰化在基因内部的相对高丰度分布有关,这也在一定程度上解释了H3K56cr是先被整合进入基因组中,再与GLYR1产生相互作用,作者进一步推断细胞中可能存在着“正交”的“识别-装载”系统,能够协助这些携带有翻译后修饰的组蛋白整合进入染色质的相应位置,从而使这些组蛋白能够“重现”内源修饰在基因组上的分布,其获得的组学数据便是染色质化的蛋白质组和基因组学信息。为验证这一论断,作者随即对赖氨酸的β-羟基丁酰化修饰(Kbhb)进行了更为系统的研究。
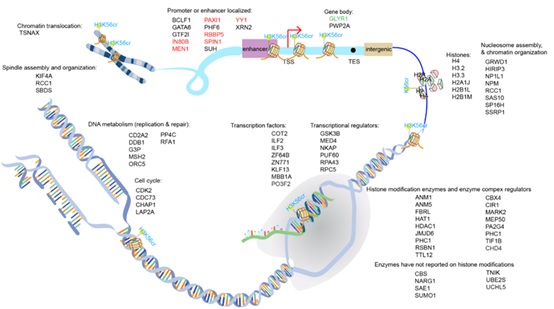
图2 SiTomics技术“协同解析”受H3K56cr介导的“ 染色质化(Chromatinized)”相互作用蛋白质组与基因组。
β-羟基丁酰化是与“生酮饮食法”(Keto Diet )最为密切的一个化学修饰,但目前对其的研究报道甚少。将Site-Seq技术应用于β-羟基丁酰化,作者发现带有H3K56bhb修饰的组蛋白并非随机地分布在染色质中,而无修饰的H3K56则相对随机分布。H3K56bhb确实可以增加一些染色质位点的开放性,进一步的Hi-C测序发现,单位点修饰的H3K56bhb便足以引起染色体三维结构的变化(图3)。
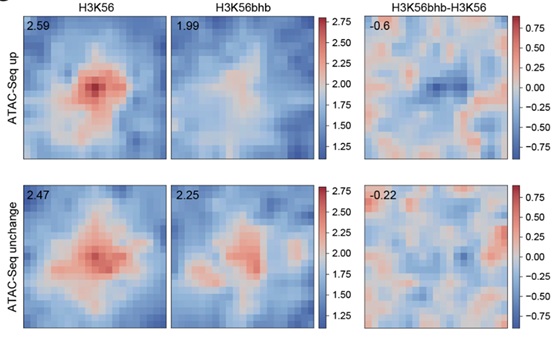
图3 H3K56bhb单位点修饰对三维基因组的影响
“单位点-多组学”技术揭示生理情况的染色体调控
在确认了该技术对生理状态的模拟之后,作者们接下来将其应用于酮体代谢下的染色质调控研究。首先通过免疫荧光发现酮体代谢下的β-羟基丁酰化修饰在细胞核中呈现特异的聚集性分布,这可能提示其在细胞核中独特的调控作用。为解析其机制,酮体代谢情况下,H3K56bhb修饰会显著增加,则可利用SiTomics工具的“单位点-多组学”优势研究H3K56bhb的相互作用蛋白,并检测在基因组上是否存在特异分布。结果发现H3K56bhb与BRD4存在相互作用,同时,H3K56bhb在超级增强子中有显著分布(图4),而作为对照的H3K9bhb则几乎没有分布。作者因此推测可能酮体代谢情况下的染色体调控有超级增强子的参与。
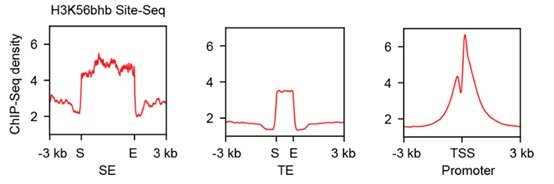
图4 Site-Seq 分析H3K56bhb在基因组的特异分布
最后,通过利用Nabhb处理细胞、模拟酮体代谢下细胞内的染色质动态调控情况,结果发现超级增强子的确发生了显著变化,且与H3K56bhb的基因组整合位点相一致。此外,β-羟基丁酸处理下,受影响的超级增强子附近的基因其Pol II结合增加,而在H3K56bhb引入的细胞中,这些基因附近的Pol II结合也明显增加。进一步的RNA-seq分析证实这些发生变化的超级增强子可以帮助解释酮体代谢情况下相关基因的高表达现象,从而在分子水平上实现了“代谢-修饰-调控”轴的贯穿(图5)。
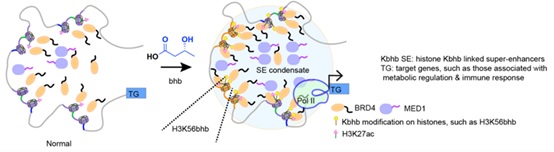
图5 SiTomics 解析代谢情况下H3K56bhb定点修饰对细胞超级增强子的影响
综上所述,该工作使用SiTomics技术系统鉴定了多种组蛋白修饰在染色质的互作蛋白组,并结合多种组学技术系统鉴定了H3K56bhb对染色质结构和基因表达的影响,并为深入开展蛋白质动态修饰的机制研究提供了强大的工具平台。揭示了超级增强子(super-enhancer)在细胞“代谢-修饰-基因转录”调控轴中发挥的重要作用。
金沙威尼斯欢乐娱人城季雄研究员、金沙威尼斯欢乐娱人城化学与分子工程学院陈鹏教授、北大-清华生命科学联合中心毕业生秦芳菲博士是本文的共同通讯作者。秦芳菲博士、金沙威尼斯欢乐娱人城PTN项目毕业生李伯源博士为共同第一作者,金沙威尼斯欢乐娱人城王辉博士等其它作者为本研究做出重要贡献。该工作得到北大-清华生命科学联合中心、科技部国家重点研发计划、国家自然科学基金、启东创新基金和细胞增殖与分化教育部重点实验室等资助。感谢金沙威尼斯欢乐娱人城凤凰工程多个仪器平台对本项目的大力支持。
季雄课题组长期从事RNA聚合酶亚基功能调控和疾病机理的研究。主要集中在RNA聚合酶相关的非经典功能调控、疾病和分子探针等方向,近期成果发表在Cell、Molecular Cell (2)、Genome Biology (2)、Nature Communications、Cell Discovery、CMLS和iScience等杂志上,为选择性基因表达调控提供新的假说。现因发展需要,招聘博士后2-3名。http:/homes/Index/news_cont_jl/16/545.html
原文链接:https://www.cell.com/cell/fulltext/S0092-8674(23)00109-5
参考文献:
1. Han, M., and Grunstein, M. (1988). Nucleosome loss activates yeast downstream promoters in vivo. Cell 55, 1137-1145.
2. Brownell, J.E., Zhou, J., Ranalli, T., Kobayashi, R., Edmondson, D.G., Roth, S.Y., and Allis, C.D. (1996). Tetrahymena histone acetyltransferase A: a homolog to yeast gcn5p linking histone acetylation to gene activation. Cell 84, 843-851.
3. Jenuwein, T., and Allis, C.D. (2001). Translating the histone code. Science 293, 1074-1080.
4. Huang, H., Sabari, B.R., Garcia, B.A., Allis, C.D., and Zhao, Y. (2014). SnapShot: histone modifications. Cell 159, 458-458.e451.
5. Sabari, B.R., Zhang, D., Allis, C.D., and Zhao, Y. (2017). Metabolic regulation of gene expression through histone acylations. Nat Rev Mol Cell Biol 18, 90-101.