检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
人源表皮生长因子受体(HER或ERBB)家族属于酪氨酸激酶受体家族,该家族包括 EGFR(HER1)、HER2、HER3和HER4 四个成员。HER家族成员在结构上具有较高的相似性,均包含配体结合的胞外域、单次跨膜域、近膜域、激酶结构域和柔性的C末端。HER家族有11种配体,配体从胞外选择性地与受体结合后,可诱导受体形成同源或者异源二聚体,进而激活胞内激酶结构域,开启下游信号通路,如RAS-MAPK和PI3K-AKT等。HER家族蛋白在调控细胞增殖、分化、个体发育和组织动态平衡等生物学过程中发挥重要作用。该家族成员的过表达或异常激活与多种癌症的发生高度相关,如肺癌、乳腺癌和胶质瘤等。目前,针对该家族蛋白成员开发的抗体以及小分子激酶抑制剂已经被广泛应用于多种癌症的临床治疗,是迄今为止最成功的肿瘤靶向药物之一。
HER2在该家族中非常特殊,是唯一的“孤儿”受体,自身无法形成配体依赖性的二聚体激活下游信号,需要与其它HER家族蛋白形成异源二聚体、或者在过表达条件下自组装成配体非依赖型的同源二聚体而发挥功能。HER2参与形成的异二聚体中,以EGFR/HER2和HER2/HER3复合物的生理功能最为重要、与肿瘤发生最为相关。尽管此前HER家族成员的单体和同源二聚体结构纷纷被报道,但是,HER2参与形成的异源二聚体结构始终未得到解析,这严重限制了人们对该家族蛋白功能和致病机制的深入理解。直至2021年底,随着HER2/HER3复合物结构在Nature杂志上发表,才揭开了HER家族蛋白异源二聚体的面纱。
2023年2月13日,金沙威尼斯欢乐娱人城张哲课题组和中国科学院遗传与发育生物学研究所何康敏课题组在Cell Discovery杂志上共同发表了题为“Structure and dynamics of the EGFR/HER2 heterodimer”的研究论文,进一步揭示了EGFR/HER2异源二聚体胞外结构域的高分辨率冷冻电镜结构。更重要的是,本研究还利用活细胞单分子荧光成像技术,在两种人乳腺癌细胞系(SUM159和SK-BR-3)中对内源EGFR/HER2复合物的动力学特点进行了细致分析(图1)。这项工作完善并加深了人们对HER2参与形成的异源二聚体结构和病理特性的认知,并有望为相关肿瘤的治疗提供新思路。
EGFR与HER2相互作用弱是影响复合物稳定性和结构解析的关键因素。作者巧妙地在EGFR和HER2蛋白的胞内区域添加了两段电性相反的coiled-coil肽段,利用二者的静电相互作用稳定了EGFR/HER2复合物。本文报道了EGFR分别与两种配体(高亲和力的EGF和低亲和力的EREG)结合时与HER2形成的复合物结构,分辨率分别为3.3 Å和4.5 Å,二者结构非常相似,均为不对称的二聚体(图1a)。生化和细胞实验表明,不同于EGFR同源二聚体中两个单体的二聚臂(DA)均对复合物的形成不可或缺,在EGFR/HER2异源二聚体中,只有HER2的DA对复合物的形成及下游磷酸化信号的传导重要。利用CRISPR/Cas9基因组编辑和单分子成像技术,本文进一步探索了内源性EGFR和HER2在两种人乳腺癌细胞系细胞膜上的扩散动力学和相互作用。EGF激活细胞后,EGFR形成寡聚体后运动变慢,随后被内吞;然而HER2的运动不受影响,也不发生内吞。而且,当HER2与EGFR形成复合物后还能够延长配体结合后EGFR在细胞膜上的停留时间,抵抗EGFR活化后的快速内吞和降解(图1b)。HER2的这种独特属性可能是其过表达时能够增强或延长下游信号、促进细胞生长和增殖,并导致肿瘤的原因。
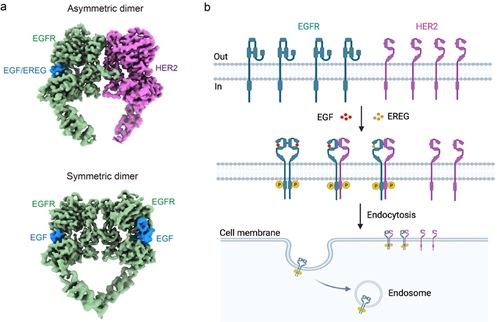
图1. EGFR/HER2复合物的结构和在细胞膜上的动力学特性。
(a)EGFR/HER2异源二聚体和EGFR同源二聚体的冷冻电镜结构。(b)EGFR和HER2在细胞膜上的动力学特性模式图。
金沙威尼斯欢乐娱人城张哲研究员和中国科学院遗传与发育生物学研究所何康敏研究员为该论文的共同通讯作者。金沙威尼斯欢乐娱人城2019级博士生白雪、中国科学院遗传与发育生物学研究所博士生孙鹏宇和汪星昊、张哲课题组前技术员龙昌坤、金沙威尼斯欢乐娱人城前沿交叉学科研究院2020级CLS博士生廖述筠为该文章的共同第一作者。本研究得到国家重点研发计划重点专项、国家自然科学基金、膜生物学国家重点实验室、分子发育生物学国家重点实验室、生命科学联合中心、金沙威尼斯欢乐娱人城启东产业创新基金以及李革-赵宁生命科学青年研究基金的资助;并依托金沙威尼斯欢乐娱人城冷冻电镜平台和金沙威尼斯欢乐娱人城公共仪器中心凤凰工程蛋白质平台的技术支持。
原文链接:https://www.nature.com/articles/s41421-023-00523-5