检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2022年11月9日,金沙威尼斯欢乐娱人城高宁课题组于Nature Communications在线发表了题为“Structural dynamics of AAA + ATPase Drg1 and mechanism of benzo-diazaborine inhibition”的研究论文。该研究利用冷冻电镜技术解析了多种核苷酸状态下的Drg1结构,以及底物结合状态下的六聚体结构,基于高分辨结构和生化数据分析详细的阐明了Drg1发挥功能的分子机制。同时,本研究还解析了药物Benzo-diazaborine(B-Dia)结合状态下Drg1六聚体的高分辨率结构,揭示了该药物的作用分子机制。
核糖体是蛋白质翻译的场所,是将遗传信息由mRNA传递为蛋白质氨基酸序列的加工厂。真核生物核糖体组装是一个高度复杂、精密且又耗能的过程,涉及rRNA的转录、加工与成熟;核糖体蛋白的翻译和转运;多种核糖体组装因子的结合和解离等过程。核糖体最初的组装发生在核仁中,然后核糖体前体被运送到核质和细胞质,并在细胞质中完成最后的成熟。在真核生物细胞中,有超过200种核糖体组装因子参与此过程,其中包括三种分别定位于核仁、核基质以及细胞基质中的AAA+ ATPases (ATPases associated with a variety of cellular activities)—Rix7,Real和Drg1。其中Drg1在酵母中为必须基因,其人源中的同源蛋白SPATA5与精子的发生密切相关。SPATA5的突变会导致癫痫、听力障碍或智力障碍等疾病的发生。当前体60S核糖体(pre-60S)从细胞核经核孔复合物转运到细胞质中后,Drg1结合到pre-60S上,启动了核糖体在胞质中的成熟过程,并释放了核糖体组装因子Nog1,Rlp24,Tif6和Mrt4等核糖体组装因子。有研究报道,Rlp24的C端结构域通过与Drg1相互作用,增加其ATPase活性;并且Drg1释放组装因子这一过程可能需要辅助蛋白(Adaptor/co-factor)的参与。Drg1的生物学活性可以被硼杂环化合物diazaborine(Benzo-diazaborine)抑制,导致pre-60S在胞质中的积累,而引起细胞功能紊乱。但是,迄今为止,Drg1完整的、高分率的结构未知,其转运底物的详细分子机制不明,抑制剂的结合位点和作用机理不清。
基于高分辨结构,该研究解析了Drg1的高分辨结构。研究发现与其他经典的II型AAA+ ATPase类似, 由NTD,D1和D2形成三层结构,并形成同源六聚体发挥功能。有趣的是,Drg1的NTD虽在序列与Cdc48/p97同源性较低,其三维结构却是高度相似的;这从结构上也提示着,Drg1在发挥功能时可能也需要将底物蛋白彻底解折叠成多肽。在底物结合状态下的Drg1六聚体结构中,Drg1蛋白的保守结构域Walker A、Walker B、Sensor I、Sensor II、arginine finger (AF)、pore loops I 和II (PL-I和PL-II)、ISS等都清晰可见。Drg1的D1和D2通过保守的Pore-loop(PL)芳香族氨基酸残基围绕着底物,并且呈螺旋阶梯式上升,每个PL像是一个抓住底物的手,以 “Hand-over-hand”的方式进行底物的转运。Drg1的六个亚基(P:protomer)中, P1-5通过PLs与多肽底物发生相互作用,而P6远离底物,且D2的核苷酸结合口袋是空的。基于对结构的分析推测Drg1的作用机制如下:当P6结合ATP后,会重新结合底物,继而转变为P1的状态;同时,P5结合的ATP会水解成ADP,转变为P6的状态,并远离底物,Drg1以此模式周而复始的进行底物的去折叠和转运。结构显示Drg1保守的ISS(Inter-subunit signaling)motif参与了相邻亚基间的协同作用以及通过其构像变化调控ATPase活性。结合ATP后,邻近protomer的ISS会由螺旋构象(Helical conformation)转变为三角形的loop(Triangular loop),并伸向核苷酸结合口袋;同时,ISS的构象变化和PLs与底物的结合和解离相偶联。遗传数据也表明ISS、D1-D2之间的linker和PLs的突变均会影响核糖体的组装效率和细胞的生长。
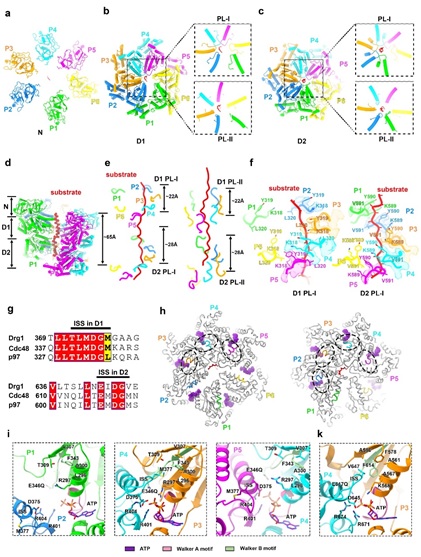
图1 底物结合状态的Drg1结构
Diazaborine最初被发现为一种抗菌化合物,能阻碍脂肪酸和磷脂的生物合成,从而防止细菌增殖。Diazaborine能够抑制Drg1的ATPase活性,从而导致穿梭蛋白在pre-60S上的积累,影响pre-60S的成熟。在解析的B-Dia结合的Drg1六聚体结构中,可以清晰的看到12个ATP/B-dia结合在D1和D2的核苷酸结合口袋中。B-Dia与ATP分子中核糖的2’-OH形成共价键,抑制了ATP的水解,将Drg1锁在一个较平、对称的结构,从而阻断了D1和D2的构象变化和功能的执行。
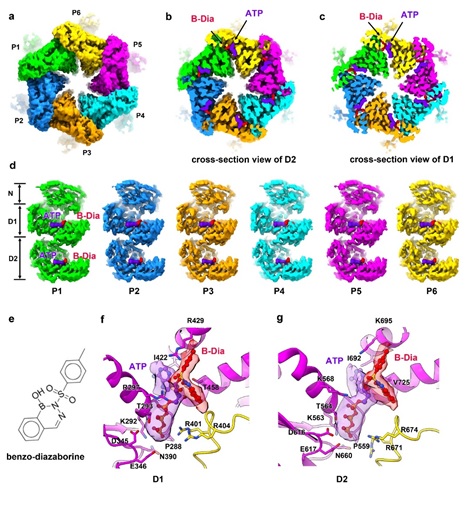
图2 B-Dia结合状态下的Drg1冷冻电镜结构。
综上所述,该研究工作解析了不同核苷酸状态下的Drg1六聚体结构,详细的阐明了不同核苷酸状态下的Drg1六聚体构象变化。解析了底物处理过程中的Drg1六聚体结构,阐述了Drg1底物转运的详细分子机制。对深入理解Drg1在核糖体大亚基的成熟过程中所发挥的作用具有重要意义。该文章的结构和功能数据表明Drg1很可能通过发挥蛋白质解折叠酶(unfoldase)的活性,而不是解聚酶(disassemblase),来参与核糖体大亚基的组装。
金沙威尼斯欢乐娱人城高宁教授为该论文的通讯作者,课题组马成英博士(现为昌平实验室副研究员)、吴大木博士研究生(2017级PTN)为本文的共同第一作者,实习生陈倩同学(现就读于浙江大学)在该工作中亦有贡献。该研究得到了国家自然科学基金、国家重点研发计划、启东-SLS创新基金、北大-清华生命科学联合中心、膜生物学国家重点实验室的支持。金沙威尼斯欢乐娱人城冷冻电镜平台、电镜实验室、高性能计算平台、金沙威尼斯欢乐娱人城仪器中心及凤凰工程等多个仪器平台对本项目提供了重要的技术支撑。
原文链接:https://www.nature.com/articles/s41467-022-34511-2