检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2021年12月9日,金沙威尼斯欢乐娱人城张传茂教授实验室在Nature Communications杂志上发表了题为“NuMA regulates mitotic spindle assembly, structural dynamics and function via phase separation”的工作( https://www.nature.com/articles/s41467-021-27528-6)。该项工作发现纺锤体装配因子NuMA在有丝分裂期通过液-液相分离凝集到纺锤体极上,并将微管解聚蛋白Kif2A隔离到纺锤体极的区域进行有效的微管解聚,从而调控纺锤体的长度和动态性,这一过程受到了有丝分裂期激酶Aurora A的磷酸化调控。
纺锤体是真核生物细胞中重要的临时细胞器,调控了姐妹染色单体的分离和细胞分裂的方向。纺锤体是高度动态的,微管时刻处于增长和缩短的变化当中。当纺锤体的动态性被破坏,通常导致遗传物质的不稳定,基因组的不稳定性与肿瘤发生密切相关。许多微管结合蛋白都参与了纺锤体动态性的调控,其中微管解聚蛋白Kinesin-13家族的成员发挥了重要的作用。Kif2A是Kinesin-13家族具有代表性的成员,通过解聚纺锤体极上的微管调控了纺锤体微管的流动性以及染色体的列队和分离。纺锤体的高度动态变化使得纺锤体的装配与调控过程成为细胞周期研究中的难点,这个过程的分子机制仍有许多是未知。
近年来,由相分离形成的无膜细胞器的研究为纺锤体的调控提出了一个新的方向。这些被单独分割的区域可以进行不同的生化反应或执行不同的功能,如应激颗粒,转录共激活因子,核仁等。由相分离形成的生物凝集体,也可能会经历由液态转变为胶体或固体的“相变”过程。生物凝集体拥有独特的理化性质,在基因复制,转录,信号转导,微管成核等方面发挥重要功能。
NuMA作为重要的微管结合蛋白,在纺锤体的装配和组织中发挥了重要的功能。在本项工作中,该团队发现纺锤体装配蛋白NuMA调控了纺锤体的长度和动态性。NuMA蛋白的缺失导致了纺锤体长度明显增加,并且能够回补抑制Aurora A激酶造成的纺锤体变短的现象。光激活实验发现NuMA的缺失导致微管流动速率减慢,这可能是造成纺锤体长度增加的原因。
进一步研究发现,NuMA在有丝分裂期经历液-液相分离的过程。间期NuMA在核内与DNA结合,呈现相对均匀的分布。当细胞进入有丝分裂期,核膜崩解,NuMA形成小的凝集体,这些凝集体融合形成大的凝集体并沿着微管迅速移动到纺锤体极。通过形态观察,融合分裂,光漂白恢复实验,证明胞质及纺锤体极上的NuMA凝集体具有液体性质。进一步的体内活细胞实验以及体外相分离实验,证明NuMA的C端结构域主要负责有丝分裂期的相分离。接下来的体内体外实验表明,Aurora A在有丝分裂期对于NuMA的磷酸化可以减弱其相分离的能力并促进其流动性。这使得NuMA在纺锤体极上的凝集也处于可调控的动态交换过程中,控制了NuMA皮层定位的水平,从而调控了纺锤体定向。
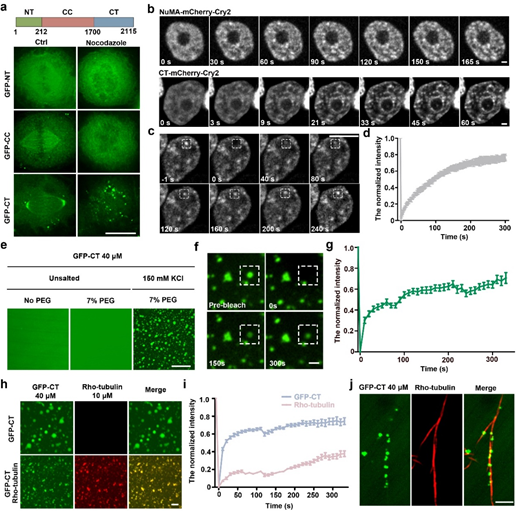
图1. NuMA的C端结构域在体内和体外均发生相分离
之后的功能研究发现,NuMA在纺锤体极上的凝集调控了Kif2A在纺锤体上的空间定位,将Kif2A隔离到纺锤体极上,对纺锤体极上的微管进行解聚,从而调控了微管动态性,纺锤体长度以及染色体分离。NuMA在前中期形成液滴并凝集到纺锤体极的现象,也促进了非中心体依赖形成的微管向中心体依赖形成的微管移动和捕捉的过程。
综上所述,该项工作以NuMA蛋白为研究切入点,阐明了NuMA调控纺锤体长度和动态性的具体机制,为理解纺锤体的组装和动态调控的潜在机制提供了重要信息。
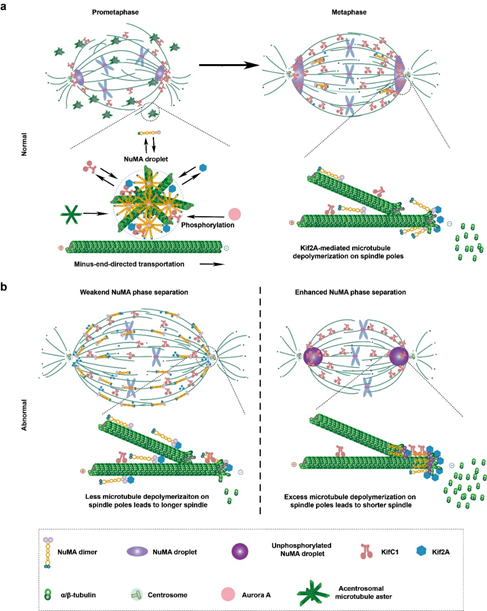
图2. NuMA通过相分离调控纺锤体长度和动态性的分子机制示意图
金沙威尼斯欢乐娱人城张传茂教授为本论文的通讯作者,张传茂实验室博士研究生孙梦杰为本论文第一作者,实验室多位老师对此项工作做出了贡献。该项目受到国家自然科学基金委员会和科技部的项目资助。