检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
DNA是主要的遗传物质,也是中心法则的源头。DNA代谢包括DNA复制、转录及DNA修复等。其中,DNA复制保证了遗传信息精确完整地传递,而转录则是细胞身份维持和功能调控的关键。DNA复制发生在整个染色质上,而转录则只发生在染色质上的转录区。如果这两个关键的细胞过程碰撞,犹如独木桥上狮虎相遇,会发生什么呢?研究表明,DNA复制和转录在转录区域的相遇会产生大量的DNA损伤 [1, 2]。为了尽量规避这种损伤,Bruce Alberts等科学家发现,转录会尽量给DNA复制让路[3];DNA复制也可能会尽量顺向而非对向跨越转录[2, 4](模型阶段,仍待证明)。那么,转录是否就任由DNA复制调(qi)控(fu)呢?是否会趁DNA复制起始时处于弱势而反过来调控DNA复制呢?
2021年6月9日,金沙威尼斯欢乐娱人城和北大-清华生命科学联合中心胡家志课题组在Genome Biology在线发表了题为“Transcription shapes DNA replication initiation to preserve genome integrity”的研究论文。在这项工作中,作者利用遗传学和基因组学的方法阐明了哺乳动物中转录调控DNA复制起始以维持基因组稳定性的机理,对于上述问题给出了肯定的答案,这是对中心法则各进程现有调控关系的一个重要补充。
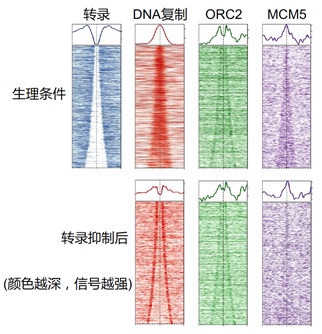
图1. 转录抑制前后,DNA复制起始、ORC2和MCM5在染色质上的分布。热图所示的中线为开放染色质区的非转录区。信号强弱用颜色深浅表示。
“工欲善其事,必先利其器”。作者首先开发了一种基于双核酸类似物次序插入的测序方法,将DNA复制的单分子金标准方法改造成了一种高通量的测序方法。利用该方法,他们发现了人和小鼠细胞中转录与DNA复制起始的相互排斥现象,即DNA复制起始仅发生在非转录区域,被限制在转录区域之外。进而,利用多种方法抑制转录,他们发现转录终止或抑制之后,DNA复制起始会侵入原本不能进入的转录区域(图1,红色)。进一步,他们发现DNA复制起始的位置改变与DNA复制起始的标志性解旋酶MCM在染色质上的重新排布密切相关(图1,紫色)。而处于DNA复制起始通路更上游的ORC复合体的位置则基本不变(图1,绿色)。该发现与已经发现的ORC和MCM的解偶联现象一致。他们的发现说明转录是促进这一解偶联现象的因素之一,并且转录具有调控DNA复制起始的能力且会抑制DNA复制起始在转录区域的发生。
下一步,作者利用基因编辑工具Cas9的核酸酶失活形式(dCas9)来阻碍特定基因的转录。他们发现dCas9对转录过程的拦截会导致DNA复制起始的标志性解旋酶MCM在拦截位置的轻微富集并进一步引起DNA复制起始(图2,左图)。该结果暗示转录可能通过直接重新部署MCM蛋白以调控DNA复制起始。更为有趣的是,这个结果还说明DNA上的“障碍”结构可能也会引起DNA复制起始,且这个过程可能并不是严格的DNA序列依赖。这与目前的一些研究发现相一致,如DNA二级结构G4被认为是一种有效的复制起始位点[5]。
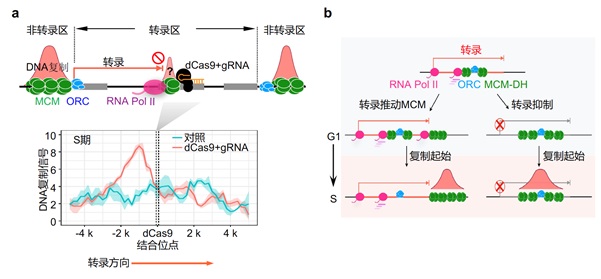
图2. DNA复制起始于转录障碍位点及“转录推土机”模型。a) 转录障碍实验原理及结果。b) 转录推土机模型:G1期,MCM双六聚体(MCM-DH)可被ORC装载于转录区,而后被RNA聚合酶II推动至下游非转录区,直到进入S期复制起始。转录抑制时,MCM可停留在转录区,S期时则在转录区起始复制。
那么,转录为何要“奋起抗争”,主动调节DNA复制起始呢?作者发现DNA复制过程会在起始位点附近产生大量的DNA损伤,与其它实验室早期的发现一致 ADDIN EN.CITE ADDIN EN.CITE.DATA [6]。同样的DNA损伤发生在基因区域和非基因区域对基因组稳定性的意义显著不同,发生在基因上的DNA损伤对于细胞的功能会有更大的潜在危害。由此,作者提出了“转录推土机”模型来解释转录对DNA复制起始的这一调控现象(图2,右图)。这些发现也引出一系列尚未回答的重要DNA代谢问题:如DNA复制这一关键生物学过程为何会诱发大量的损伤,成为大多数肿瘤的主因?作为转录和DNA复制的载体,染色质结构可以显著调控转录,那么它们是如何影响DNA复制呢?下回分解,敬请期待!
胡家志研究员为该论文的通讯作者。金沙威尼斯欢乐娱人城博士后刘阳、博士研究生艾晨及前沿交叉学科学院博士研究生甘婷婷为该论文的共同第一作者。吴锦淳、蒋永鹏、刘栩豪、卢如森在该工作中亦有重要贡献。该研究还获得了金沙威尼斯欢乐娱人城染色质维态研究中心的高宁教授、李晴教授和季雄研究员的支持与合作。该工作得到了北大-清华生命科学联合中心、科技部国家重点研发计划、国家自然科学基金、细胞增殖与分化教育部重点实验室以及金沙威尼斯欢乐娱人城仪器中心(成像平台及流式平台)的大力支持。
论文链接:https://genomebiology.biomedcentral.com/articles/10.1186/s13059-021-02390-3
实验室介绍:
金沙威尼斯欢乐娱人城胡家志实验室关注细胞发育和DNA代谢过程中的基因组稳定性,主要研究兴趣是:DNA代谢过程中的基因组稳定性与肿瘤发生、免疫细胞发育与成熟过程中基因组的重组与稳定、基因编辑过程中的染色质结构改变与基因编辑安全性。欢迎对相关方向感兴趣的研究生或博士后加入本实验室( http://hulab.pku.edu.cn/)。
参考文献
1. Garcia-Muse T, Aguilera A: Transcription-replication conflicts: how they occur and how they are resolved. Nat Rev Mol Cell Biol 2016, 17:553-563.
2. Hamperl S, Bocek MJ, Saldivar JC, Swigut T, Cimprich KA: Transcription-Replication Conflict Orientation Modulates R-Loop Levels and Activates Distinct DNA Damage Responses. Cell 2017, 170:774-786 e719.
3. Liu B, Wong ML, Tinker RL, Geiduschek EP, Alberts BM: The DNA replication fork can pass RNA polymerase without displacing the nascent transcript. Nature 1993, 366:33-39.
4. Chen YH, Keegan S, Kahli M, Tonzi P, Fenyo D, Huang TT, Smith DJ: Transcription shapes DNA replication initiation and termination in human cells. Nat Struct Mol Biol 2019, 26:67-77.
5. Valton AL, Hassan-Zadeh V, Lema I, Boggetto N, Alberti P, Saintome C, Riou JF, Prioleau MN: G4 motifs affect origin positioning and efficiency in two vertebrate replicators. EMBO J 2014, 33:732-746.
6. Tubbs A, Sridharan S, van Wietmarschen N, Maman Y, Callen E, Stanlie A, Wu W, Wu X, Day A, Wong N, et al: Dual Roles of Poly(dA:dT) Tracts in Replication Initiation and Fork Collapse. Cell 2018, 174:1127-1142 e1119.