检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
金沙威尼斯欢乐娱人城朱健课题组2021年2月1日在Journal of Cell Biology发表了题为 “Competition between two phosphatases fine-tunes Hedgehog signaling” 的研究论文。该项研究发现了磷酸酶PP6的催化亚基PpV特异地调控Hedgehog (Hh) 信号途径,阐释了PpV通过竞争结合磷酸酶PP2A调节亚基Widerborst (Wdb) 介导Wdb蛋白降解,并且作为Hh的直接感受器精密调节Hh稳态的作用机制。
多细胞生物个体由单一受精卵发育成熟而来。在这个复杂的发育进程中,基因的时空表达受到精细和完善的调控。经典的Hh信号途径进化上高度保守,在发育过程中的多个方面起着至关重要的作用,包括细胞增殖、模式形成、细胞干性维持和成体组织稳态等,其失调会引起严重的人类发育缺陷和多种癌症。
Hh信号途径的激活依赖于激活蛋白Smoothened (Smo) 的磷酸化及其介导的细胞膜定位。蛋白激酶PKA和CKI对Smo级联磷酸化以响应不同浓度的Hh信号,有选择地激活下游目的基因。朱健课题组的前期工作发现磷酸酶PP1和PP2A分别拮抗PKA和CKI的活性以维持Smo级联磷酸化的稳态。其中PP2A的B’/B56调节亚基Wdb特异地调控PP2A对Smo的活性。由于已有的实验证据表明PKA和CKI并不受Hh信号直接调控,PP1和PP2A-Wdb是如何响应Hh信号成了Hh信号传导机制的一个重要环节。
在本工作中,研究团队首先发现PpV表达水平的下调无法维持高水平Smo磷酸化介导的Hh信号激活,这与wdb过度激活的表型极为相似。遗传学实验证实了PpV作用于wdb的上游,PpV对Hh信号途径的调控作用依赖于Wdb的活性。随后团队发现在PpV基因敲除突变体中,Wdb的蛋白水平显著上调。进一步生化实验证实PpV与Wdb直接结合并介导了后者的泛素化和随后在蛋白酶体中的降解。值得注意的是,PpV对Wdb蛋白稳态的调控并不依赖于PpV的磷酸酶活性,而是通过与PP2A催化亚基PP2Ac/Mts竞争结合Wdb从而引起PP2A全酶解聚,从全酶中解聚的Wdb被蛋白酶体识别并降解。
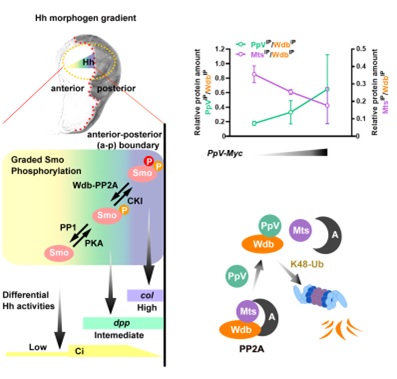
PpV竞争结合Wdb以调控Smo级联磷酸化介导的Hh信号梯度激活
由于Hh信号通过转录后调控的方式降低了Wdb的蛋白表达, 因此PpV可能做为Hh的直接感受器来接驳Hh信号和Wdb-PP2A的活性。PpV的免疫荧光染色显示其确实存在与Hh信号梯度激活相吻合的表达图式:中低水平的Hh信号激活并稳定PpV,极高水平的Hh信号抑制PpV。更值得注意的是,Hh信号转录因子Ci/Gli的结合位点在PpV的调控序列中成簇存在,暗示PpV极有可能是Hh信号的直接靶基因。此外,PpV的调控序列中也存在转录抑制因子En/EN1的转录结合位点,而En则是响应极高水平Hh的直接靶基因之一。通过对PpV调控序列中顺式作用元件的功能分析,团队充分阐释了Ci/Gli与En/EN1协同作用形成PpV表达图示的原因。综上所述,PpV直接感受Hh信号梯度,通过调控Wdb-PP2A的活性组成了包含多个负反馈循环的磷酸酶调控网络,极大地增强了Hh信号途径稳态的调节能力。本工作完善了Hh信号传导机制的关键环节,为深入理解Hh信号稳态的调控提供了重要信息,对人类先天发育缺陷和包括癌症在内的疾病预防和临床治疗有重要的意义。
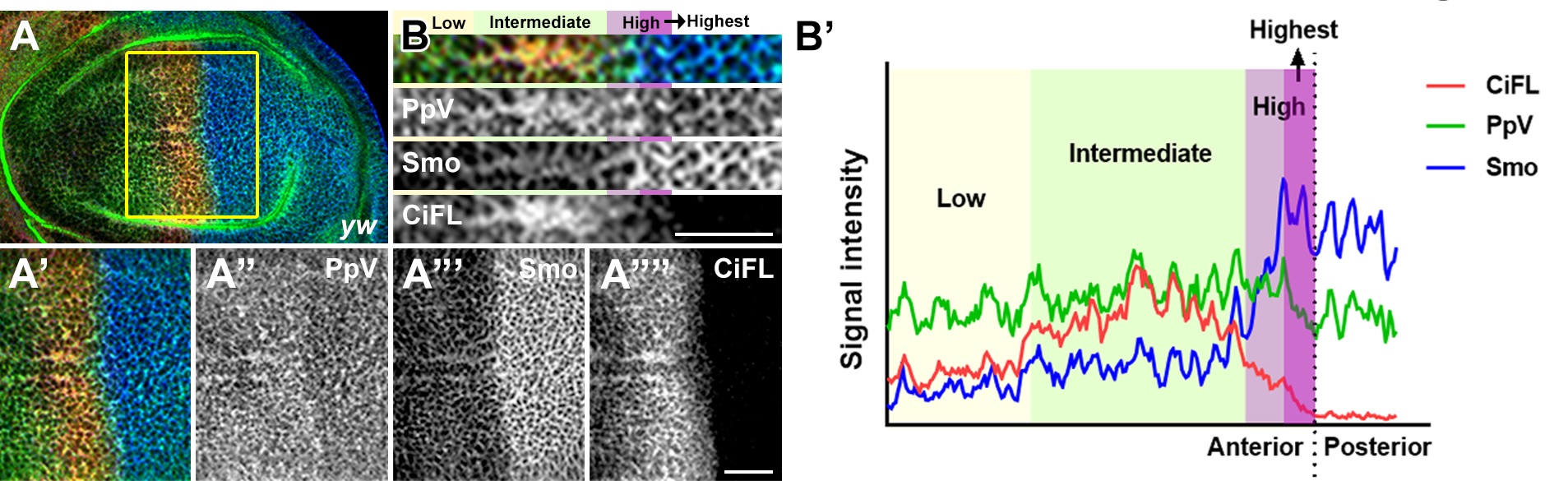
PpV响应Hh信号梯度
金沙威尼斯欢乐娱人城、生命科学联合中心朱健研究员和朱健课题组已出站博士后,中国海洋大学海洋生命学院、海洋生物多样性与进化研究所苏颖教授为本论文的共同通讯作者,朱健课题组刘敏副研究员、前沿交叉学科研究院2014级已毕业博士研究生刘爱国和金沙威尼斯欢乐娱人城2019级博士研究生王洁为论文的共同第一作者。2017级博士研究生张延松和2013级已毕业博士研究生李亚娟参与了部分工作。该项研究得到了国家自然科学基金、生命科学联合中心、细胞增殖与分化教育部重点实验室、金沙威尼斯欢乐娱人城仪器中心以及凤凰平台的大力支持。
原文链接:https://rupress.org/jcb/article/220/2/e202010078/211641